A. Dẫn nhập
Thuốc ức chế kết tập tiểu cầu ( UCKTTC ) có vai trò quan trọng trong phòng ngừa biến cố huyết khối tái phát ở bệnh nhân hội chứng mạch vành cấp, đặc biệt quan trọng ở bệnh nhân có can thiệp mạch vành qua da ( PCI ) 1,3 .
PGS.TS Võ Thành Nhân
Trưởng khoa TMCT BV Chợ Rẫy
Tăng mức độ ức chế kết tập tiểu cầu sẽ làm giảm đáng kể nguy cơ biến cố huyết khối tái phát4, nhưng lại tăng rủi ro tiềm ẩn xuất huyết5, 6, thế cho nên cân đối giữa biến cố huyết khối và xuất huyết là tiềm năng điều trị của những thuốc UCKTTC. Các xét nghiệm đánh giá phản ứng tiểu cầu nhằm mục đích tiên đoán tốt hơn về những biến chứng thiếu máu cục bộ cơ tim và / hoặc xuất huyết3, 9. Tuy nhiên, do thiếu vật chứng về mức độ đối sánh tương quan giữa việc điều trị thuốc ức chế thụ thể P2Y12 dưới hướng dẫn của xét nghiệm chức năng tiểu cầu và kết cục lâm sàng, nên những hướng dẫn lúc bấy giờ khuyến nghị việc xét nghiệm chức năng tiểu cầu ( PFT ) chỉ ở những bệnh nhân tinh lọc và không phải là một phần của thực hành thực tế lâm sàng thường qui1, 2, 10. Mặc dù chưa đủ dẫn chứng về thời gian và phương pháp sử dụng xét nghiệm chức năng tiểu cầu ( PFT ), câu hỏi luôn được bác sỹ lâm sàng đặt ra là giá trị của những xét nghiệm chức năng tiểu cầu này như thế nào trong tiên lượng biến cố huyết khối tái phát và / hoặc xuất huyết ? Vì vậy, bài báo này sẽ cung ứng những kỹ năng và kiến thức cơ bản về những xét nghiệm đánh giá chức năng tiểu cầu hiện có, và cách diễn giải hiệu quả của những xét nghiệm này trong tiên đoán kết cục lâm sàng để bác sỹ lâm sàng hoàn toàn có thể sử dụng đúng những xét nghiệm chức năng tiểu cầu trên thực hành thực tế .
B. Mối tương quan giữa hoạt hóa tiểu cầu cao và hoạt hóa tiểu cầu thấp trong khi điều trị với biến cố huyết khối tái phát và xuất huyết như thế nào?
Nhiều nghiên cứu và điều tra về chức năng tiểu cầu đã cho thấy rằng 30-50 % bệnh nhân ( tùy theo xét nghiệm nào đã được sử dụng ) có phản ứng tiểu cầu cao trong điều trị ( high on-treatment platelet reactivity : HTPR ) khi đang điều trị với clopidogrel72, 73. Hơn 20.000 bệnh nhân trong nghiên cứu và điều tra đã cho thấy có sự tương quan giữa HTPR và biến cố nhồi máu với sự tương quan mạnh nhất so với những biến cố huyết khối thời gian ngắn trong những bệnh nhân có can thiệp mạch vành qua da ( PCI ) ( odd ratio ( OR ) : 2-10 ) 74,78. Xét nghiệm chức năng tiểu cầu qua kích hoạt adenosine diphosphate ( ADP ) là một yếu tố tiên lượng tốt nhất cho biến cố nhồi máu ở những bệnh nhân được điều trị với liệu pháp kháng tiểu cầu kép75, 76,77,79,80. Tuy nhiên, mối quan hệ độc lập giữa HTPR, phản ứng tiểu cầu và kết cục lâm sàng đã không được chứng tỏ một cách hằng định. Một vài nghiên cứu và điều tra gần đây xác lập rằng hoàn toàn có thể có một hành lang cửa số điều trị so với những thuốc chẹn thụ thể P2Y12, HTPR tương quan đến những biến cố huyết khối, trong khi phản ứng tiểu cầu thấp trong điều trị ( LTPR ) hoàn toàn có thể tương quan đến những biến cố chảy máu 81,82 ( Hình 1 ) .
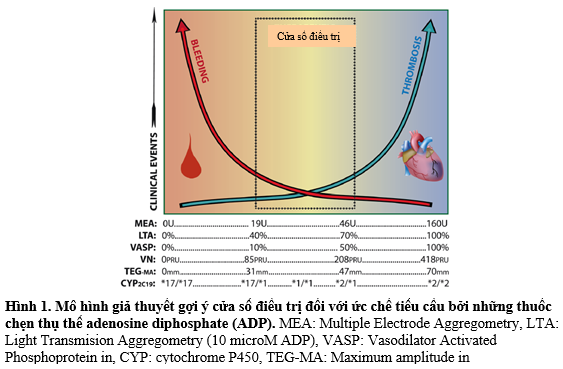
Nhiều yếu tố lâm sàng và nhân khẩu học tương quan với HTPR ở những bệnh nhân được điều trị với clopidogrel. Những yếu tố này gồm có : béo phì, rối loạn chức năng thận, đái tháo đường, tuổi cao, chức năng thất trái giảm, viêm nhiễm và có hội chứng vành cấp83, 84
C. Các xét nghiệm chức năng tiểu cầu có tương đương nhau không?
Trong điều kiện kèm theo in vivo của chấn thương động mạch, bộ ba yếu tố là kết dính – kích hoạt – kết tập tiểu cầu dẫn đến hình thành cục máu đông với nhiều tiểu cầu được kết nối chặt trải qua việc khởi phát đồng thời của con đường đông máu11. Các con đường chính, nơi mà những loại thuốc kháng tiểu cầu can thiệp vào những quy trình này gồm có :
a ) Ức chế thromboxane – A2 bởi acid salicylic acetylic ( ASA ) ,
b ) Ức chế thụ thể ADP P2Y12 ,
c ) Ức chế thụ thể thrombin PAR-1 ,
d ) Ức chế thụ thể glycoprotein ( GP ) IIbIIIa .
Mặc dù nhiều xét nghiệm chức năng tiểu cầu khác nhau đã được tăng trưởng để theo dõi hiệu suất cao của những thuốc kháng tiểu cầu, những xét nghiệm đáng đáng tin cậy và sử dụng thoáng đãng nhất trên lâm sàng phản ánh hiệu suất cao kháng tiểu cầu là của những thuốc ức chế P2Y123, 9. Ngược lại, do cung ứng ASA thường là không chuyên biệt, hoàn toàn có thể xác lập tỷ suất cao không bình thường của những bệnh nhân được coi là “ kháng ASA ” 12 .
Không có tài liệu vai trò lâm sàng của việc đo mức độ ức chế thụ thể PAR-1 hoặc hiệu suất cao của những chất ức chế glycoprotein IIbIIIa. Do đó, đánh giá chức năng tiểu cầu lúc bấy giờ sẽ khu trú vào điều trị bằng thuốc ức chế P2Y12 ở những bệnh nhân bị hội chứng mạch vành cấp trải qua PCI .
· Những yếu tố ảnh hưởng đến kết quả xét nghiệm chức năng tiểu cầu:
o Quy trình xét nghiệm ( lỗi do lấy mẫu, chuẩn bị sẵn sàng và giải quyết và xử lý mẫu … ) : cần phải tuân thủ khắt khe hướng dẫn của nhà phân phối .
o Thời gian chờ đón bắt đầu sau khi lấy máu để cho máu cân đối với thuốc kháng đông ở nhiệt độ phòng : trong trường hợp của xét nghiệm Multiplate ® ADP là 30 phút và 10 phút trong trường hợp của xét nghiệm VerifyNow ® P2Y12 .
o Mẫu phải được giải quyết và xử lý tốt nhất trong vòng 2 giờ sau khi lấy mẫu và không được tàng trữ trong thời hạn dài hơn do sự khởi đầu tổn thương tiểu cầu trong mẫu đó hoàn toàn có thể góp thêm phần tạo ra giá trị giả của phản ứng tiểu cầu thấp
o Số lượng tiểu cầu trong máu, Hct .
· Các xét nghiệm chức năng tiểu cầu có tương đương nhau không?
Bảng 1: Những phương pháp được sử dụng để đánh giá hiệu quả của các thuốc kháng tiểu cầu.
Các xét nghiệm chức năng tiểu cầu hiện có khác nhau đáng kể về chiêu thức được sử dụng để đánh giá phản ứng tiểu cầu trong thực trạng ức chế P2Y12
|
Xét nghiệm |
Nguyên lý |
Thông số đo lường |
Mẫu máu |
Đồng vận |
Độ nhạy đối với thuốc kháng tiểu cầu |
Tham khảo |
| Light transmission aggregometry ( LTA ) | Đo ngưng kết quang học | % kết dính tiểu cầu | Huyết tương giàu tiểu cầu | ADP, AA, collagen, epinephrine, TXA2 | Chất ức chế P2Y12, aspirin, Chất ức chế GPIIb / IIIA | 87,77,79,88,80,89,90,91,92,93,94 |
| Multiple analyzer ( MEA ) | Đo ngưng kết trở kháng | Diện tích dưới đường cong kết dính AUC = AU * phút ( 1 U = 10 AU * phút | Máu toàn phần | ADP, ADP + PGE1, AA, collagen, TRAP-6, ristocetin | Chất ức chế P2Y12, aspirin, Chất ức chế GPIIb / IIIA | 95,96,97,105 |
| Vasodilator activated phosphoprotein ( VASP P2Y12 ) phospholyration assay | Fow cytometry | Chỉ số phản ứng tiểu cầu PRI ( % ), khoảng chừng giá trị 0-100 % | Máu toàn phần | ADP, ADP + PGE1 , | Chất ức chế P2Y12 , | 75,98,99,100,101 |
| Platelet surface receptors : P-selectin, PAC-1 | Flow cytometry | Kích hoạt thụ thể tiểu cầu | Máu toàn phần | ADP, AA, TRAP-6 | Chất ức chế P2Y12, aspirin , | 93,103,104 |
| VerifyNow P2Y12 | Đo độ đục ; sự kết dính vi hạt | Đơn vị phản ứng tiểu cầu ( PRU ), khoảng chừng giá trị 0-400 PRU | Máu toàn phần | ADP + PGE1, AA | Chất ức chế P2Y12, aspirin, Chất ức chế GPIIb / IIIa | 105,91,93,106,107,108 |
| Impact ( Cone and Platelet Analyzer ; CPA | Sự ngưng kết do biến dạng | Dính tiểu cầu | Máu toàn phần | ADP, ADP + PGE1, AA | Chất ức chế P2Y12, aspirin ( + chất rối loạn chức năng tiểu cầu ) | 109,100,150 |
| PFA-100 | Sự ngưng kết do biến dạng | Thời gian đóng ( closure time ) | Máu toàn phần |
ADP + collagen ADP + PGE1 + collagen, AA + colagen |
Chất ức chế P2Y12, aspirin , | 117,109,110,112,113 |
| Plateletworks | Đếm tiểu cầu kết dính | Đếm tiểu cầu | ADP, AA, collagen | Chất ức chế P2Y12, aspirin, Chất ức chế GPIIb / IIIA | 91 | |
| Thrombelastography ( TEG ) | Đo lường độ chắc của cục máu đông do sợi-tiểu cầu | Độ chắc cục máu đông – mức độ tối đa ( phút ) | Máu toàn phần | ADP + reptilase + FXIIIa, AA + reptilase + FXIIIa | Chất ức chế P2Y12, aspirin, Chất ức chế GPIIb / IIIA | 114,115 |
( AA : arachidonic acid, ADP : adenosin diphosphate, AA, PAC-1 : antibody that binds to the active conformation of interin anphaIIIb beta3, PGE1 : prastaglandin É, TRAP-6 : thrombic receptor activating peptid 6, TXA2 : thromboxane. )
Không có những nghiên cứu và điều tra nào so sánh tính tương tự giữa những xét nghiệm. Dựa trên hạn chế này và dựa trên những vật chứng hiện có, VerifyNow ®, Multiplate ®, VASP-P assay ®, và LTA được xác nhận trong cỡ mẫu đủ lớn để Dự kiến huyết khối trong stent và chảy máu ở những bệnh nhân hội chứng mạch vành cấp3, 9 .
Kết quả với những xét nghiệm khác hoặc là gây tranh cãi ( PFA-100 ® ) hoặc là hạn chế ( Innovance ®, Plateletworks ® ) 15, 23. Chuẩn hóa và tương đương xét nghiệm cũng là những yếu tố quan trọng so với những xét nghiệm chức năng tiểu cầu để được sử dụng trong thực hành thực tế lâm sàng. Về mặt nghiên cứu và phân tích, không có xét nghiệm nào được chuẩn hóa cho đến nay, nhưng những giải pháp hiện có trên thị trường ( ví dụ VASP-P ®, Multiplate ® và VerifyNow ® ) được chuẩn hóa so với LTA và cho hiệu quả tương tự trong những phòng thí nghiệm khác nhau. Hạn chế so với LTA là thiếu sự chuẩn hóa về sẵn sàng chuẩn bị mẫu, vận tốc ly tâm, nồng độ chất chủ vận, tàng trữ mẫu và chuyên viên trong việc triển khai phương pháp3. Như vậy, VerifyNow ® được xem là xét nghiệm chuẩn duy nhất trong đánh giá chức năng tiểu cầu .
D. Chúng ta diễn giải kết quả xét nghiệm chức năng tiểu cầu như thế nào?
Điều quan trọng là phải phân biệt giá trị chẩn đoán và giá trị tiên lượng của một xét nghiệm. Giá trị chẩn đoán được đánh giá bằng nghiên cứu và phân tích độ nhạy, độ đặc hiệu, giá trị tiên đoán dương ( PPV ) và giá trị tiên đoán âm ( NPV ). Hai chỉ số sau ( PPV và NPV ) đều bị tác động ảnh hưởng bởi tần suất lưu hành của biến cố chăm sóc ; do đó, PPV của một xét nghiệm chẩn đoán sẽ luôn luôn là thấp nếu biến cố đó là hiếm, ví dụ điển hình như trong trường hợp của huyết khối trong stent15. Để đánh giá giá trị tiên lượng, phải xác lập độ mạnh của những mối quan hệ ( tỷ số chênh [ OR ], hoặc tỉ số rủi ro tiềm ẩn [ HR ] ) và giá trị của điểm lưu lại trong phân loại lại những cá thể thành những nhóm rủi ro tiềm ẩn mới ( chỉ số tái phân loại thực sự, [ NRI ] ) nên được sử dụng 29. Vì vậy, phản ứng tiểu cầu nên được đánh giá như là giá trị tiên lượng khi ước đạt rủi ro tiềm ẩn của những biến cố huyết khối hoặc chảy máu tái phát sau PCI3, 29
· Lý do liên quan đến những hạn chế của xét nghiệm chức năng tiểu cầu
– Thiếu sự thống nhất về điểm cắt tối ưu so với HTPR và sự chuẩn hóa thấp của những chiêu thức ( Bảng 1 ) .
– Kỹ thuật ( chất chống đông được sử dụng và thời hạn trì hoãn ) và về mặt hóa học ( chất đồng vận và nồng độ của nó ) 85, 86
– Một hạn chế khác của xét nghiệm chức năng tiểu cầu ngoài khung hình : điều kiện kèm theo thử nghiệm mà hầu hết những xét nghiệm này được triển khai. Những tiểu cầu được lấy ra khỏi thiên nhiên và môi trường tự nhiên của chúng và sau đó được kích thích lại bằng một yếu tố tinh lọc. Những qui trình này đã bỏ lỡ nhiều chất kích thích tiểu cầu, tác động ảnh hưởng đồng thời trong khung hình sống cũng như chức năng ngoại tiết của tiểu cầu, ví dụ điển hình phóng thích những chất trung gian ( ví dụ thromboxan A2, serotonin, những chất khác ), những yếu tố này hoàn toàn có thể ảnh hưởng tác động lên những tiềm năng ngoài tiểu cầu ảnh hưởng tác động đến kết cục lâm sàng, và cũng đã bỏ lỡ những trường hợp khác do tiểu cầu bị kích thích trong hội chứng mạch vành cấp so với đau thắt ngực không thay đổi cũng như sự tương tác với những tế bào bạch cầu hoặc cytokine huyết tương87. Những thành phần này được cho phép tiên đoán so với hiệu suất cao dược lý học của một thuốc được sử dụng – một đối vận ADP : nếu thuốc này không ngăn ngừa sự kết tập tiểu cầu do ADP kích thích in vitro, thì nó cũng sẽ không xảy ra trong in vivo. Tuy nhiên, Tóm lại ngược lại cũng không hề rút ra – ví dụ điển hình, một hợp chất hoạt động giải trí in vitro thì cũng hoàn toàn có thể kỳ vọng hoạt động giải trí trong in vivo để ngăn ngừa sự tạo thành huyết khối nhờ vào tiểu cầu .
E. Có sự liên hệ giữa kết quả xét nghiệm chức năng tiểu cầu với kết cục lâm sàng của bệnh nhân hội chứng mạch vành cấp hay không?
· Phản ứng tiểu cầu và huyết khối trong stent
Huyết khối trong stent là một biến chứng hiếm gặp nhưng nghiêm trọng của PCI với nhiều yếu tố quyết định hành động gồm có những đặc thù lâm sàng của bệnh nhân ( HCMVC, đái tháo đường, sốc ), độ phức tạp của những tổn thương điều trị, loại stent được sử dụng và tuân thủ thuốc kháng tiểu cầu30-32. Phản ứng tiểu cầu cao trong điều trị ( HTPR, cũng được gọi là cung ứng kém ) với những thuốc ức chế thụ thể P2Y12 được xem là một chỉ dấu rủi ro tiềm ẩn quan trọng trên lâm sàng so với huyết khối trong stent3, 9. Rất nhiều nghiên cứu và điều tra quan sát đã đánh giá đối sánh tương quan giữa ước tính chức năng tiểu cầu và huyết khối trong stent33-36 ( Bảng 2 ). Ngoài ra, điều tra và nghiên cứu sổ bộ đa vương quốc, đa TT, tiến cứu ADAPT-DES 15, được phong cách thiết kế để đánh giá giá trị tiên lượng của xét nghiệm chức năng tiểu cầu ( PFT ) trong 8.500 bệnh nhân, cho thấy HPR so với ADP ( được định nghĩa khi PRU lớn hơn 208 ) là một yếu tố dự báo mạnh và độc lập ( HR : 2,49, khoảng chừng đáng tin cậy 95 % [ KTC ] 1,43 – 4,31, p < 0,001 ) của huyết khối trong stent chắc như đinh hoặc hoàn toàn có thể có sau một năm . Phản ứng tiểu cầu với ADP hoàn toàn có thể được coi như một dấu ấn sinh học có giá trị tiên lượng để cải tổ dự báo của huyết khối stent ngoài những yếu tố rủi ro tiềm ẩn lâm sàng đã biết ở những bệnh nhân sau PCI3, 9. Tuy nhiên, rủi ro tiềm ẩn tương quan với HTPR bị chi phối bởi những đặc thù lâm sàng và tác dụng thủ pháp của những cá thể được điều tra và nghiên cứu. Ví dụ, tính đúng chuẩn dự báo của HTPR so với ADP là cao hơn ở những bệnh nhân với HCMVC ( HR hiệu chỉnh : 3,91 ( KTC 95 % : 1,51 - 10,11 ), p = 0,005 ) so với bệnh động mạch vành không thay đổi ( HR hiệu chỉnh : 1.49 ( KTC 95 % : 0,35 - 6,36 ), p = 0,59 ) trong thời hạn 30 ngày kể từ ngày theo dõi trong ADAPT-DES37 . So với toàn cảnh PCI cấp tính, HTPR so với ADP có vẻ như ít có tương quan hơn ở bệnh nhân HCMVC được điều trị mà không tái thông mạch máu. Trong điều tra và nghiên cứu phụ về chức năng tiểu cầu của thử nghiệm Trilogy-ACS38, trong đó bệnh nhân HCMVC được điều trị nội khoa đã được chọn vào, phản ứng tiểu cầu không phải là một yếu tố dự báo độc lập của tử trận, nhồi máu cơ tim hay đột quỵ trong nghiên cứu và phân tích có hiệu chỉnh . Cuối cùng, mặc dầu có những vật chứng mạnh về HTPR trong khi điều trị với clopidogrel, sự tương quan của HTPR ở bệnh nhân tiếp xúc với prasugrel hoặc ticagrelor là không rõ ràng. HTPR ít phổ cập ở những bệnh nhân được điều trị với prasugrel hoặc ticagrelor hơn so với những bệnh nhân điều trị với clopidogrel39, 40, và đối sánh tương quan của nó với kết cục vẫn chưa được xác lập. Chỉ có một điều tra và nghiên cứu nhỏ cho thấy rằng những bệnh nhân được điều trị với prasugrel bị HTPR hoàn toàn có thể có rủi ro tiềm ẩn bị những biến cố huyết khối41, nhưng điều này cần phải được xác nhận một cách độc lập .
Bảng 2: Giá trị tiên lượng của phản ứng tiểu cầu đối với dự đoán huyết khối stent và chảy máu
|
Tác giả chính (tham khảo) |
Xét nghiệm |
Điểu cắt đối với huyết khối stent |
OR đối với huyết khối stent |
p |
Điểu cắt đối với chảy máu |
OR đối với chảy máu |
p |
|
Stone ( 15 ) ( ADAPT-DES ) |
VerifyNow | > 208 PRU |
HR : 2,49 ( 1,43 – 4,31 ) |
0,001 | < 95 PRU |
OR : 1,48 ( 1,21 – 1,81 ) |
< 0,001 |
| Park ( 55 ) | VerifyNow | > 235 PRU |
HR : 1,45 ( 0,27 – 7,92 ) |
0,67 | < 235 PRU |
HR : 0,78 ( 0,35 – 1,69 ) |
0,52 |
| Cuisset ( 52 ) | VASP | – | – | – | < 10 % PRI |
OR : 4,7 ( 0,35 – 1,69 ) |
< 0,001 |
| Cuisset ( 26 ) | VASP | Không báo cáo giải trình | Không báo cáo giải trình | 0,10 | – | – | – |
| Bonello ( 53 ) | VASP | 50 % PRI |
OR : 7,45 ( 1,49 – 41,36 ) |
0,02 | < 16 % PRI |
OR : 2,64 ( 0,52 – 13,36 ) |
0,24 |
|
Sibbing ( 50 ) ( ISAR ) |
Multiplate | > 46 U |
OR : 6,44 ( 2,38 – 17,38 ) |
< 0,001 | < 19 U |
OR : 2,6 ( 1,3 – 5,2 ) |
0,005 |
| Siller-Matula ( 24 ) | Multiplate | > 48 U |
OR : 36,9 ( 4,3 – 319 ) |
< 0,001 | < 20 U | Không báo cáo giải trình | 0,32 |
| Gộp chung * | n = 14.533 |
OR: 3,27 ( 2,21 – 4,85 ) |
< 0,00001 | N = 15.673 |
OR : 1,68 ( 1,41 – 2,00 ) |
< 0,0001 | |
| * OR Gộp chung được đo lường và thống kê bằng cách gộp chung những biến cố với giải pháp Mantel-Heanszel thành một nghiên cứu và phân tích gộp ảnh hưởng tác động cố định và thắt chặt từ những điều tra và nghiên cứu đã báo những biến cố đó so với huyết khối stent và / hoặc chảy máu ( xem Hình 1 ), OR : odd ratio, HR : hazard ratio | |||||||
· Điểm cắt tối ưu để tiên đoán huyết khối trong stent
Điểm cắt để Dự kiến huyết khối trong stent chỉ hoàn toàn có thể được khuyến nghị cho những xét nghiệm chức năng tiểu cầu được tương đồng hóa rất đầy đủ. Phù hợp với những khuyến nghị của hai tài liệu đồng thuận gần đây3, 9, VerifyNow ®, Multiplate ® và xét nghiệm VASP-P ® thỏa mãn nhu cầu những tiêu chuẩn như vậy. Mặc dù người ta giả thuyết rằng những giá trị điểm cắt tối ưu hoàn toàn có thể khác nhau theo biểu lộ lâm sàng và thời hạn từ khi thực thi PCI, không có đủ chứng cứ để xác lập một cách riêng không liên quan gì đến nhau những ngưỡng so với những nhóm khác nhau. Dựa trên tài liệu hiện tại, khuyến nghị chỉ hoàn toàn có thể được đưa ra cho dân số bệnh nhân chung so với từng thiết bị được chuẩn hóa .
Nguồn tài liệu lớn nhất về đối sánh tương quan giữa phản ứng tiểu cầu và huyết khối trong stent thu được so với xét nghiệm VerifyNow ® P2Y12 và những nghiên cứu và điều tra bắt đầu cho thấy một ngưỡng tối ưu trong khoảng chừng 230 – 240 đơn vị chức năng phản ứng tiểu cầu ( PRU ) 23, 42. Phân tích hậu kiểm của nghiên cứu và điều tra GRAVITAS đề xuất một điểm cắt thấp hơn, 208 PRU43, đã được liên tục chứng minh và khẳng định là đúng mực hơn trong điều tra và nghiên cứu ADAPT-DES15 .
Trong trường hợp của Multiplate ® analyzer, điều tra và nghiên cứu lớn nhất được triển khai bởi Sibbing và tập sự, gồm có 1.608 bệnh nhân, đã đề xuất điểm cắt tối ưu là 46 đơn vị chức năng ( U ; tương tự với 468 AU * phút ) để Dự kiến huyết khối trong stent, với HR = 5,4 ( KTC 95 % : 1,9 – 15,6, p = 0,002 ) ở thời hạn theo dõi một năm. 44 Hai điều tra và nghiên cứu sau đó đã xác nhận rủi ro tiềm ẩn cao hơn so với huyết khối trong stent bằng cách sử dụng điểm cắt này khi so với bệnh nhân dưới 46 U24, 45 .
Với VASP, hầu hết những điều tra và nghiên cứu trước đây đề xuất là 50 % chỉ số phản ứng tiểu cầu ( PRI ) để Dự kiến những biến chứng huyết khối46, 47. Mặc dù 1 số ít điều tra và nghiên cứu gần đây đã yêu cầu một điểm cắt cao hơn một chút ít ( 60 % ) 21, 48, điều này đã không được xác nhận trong một nhóm bệnh nhân đủ lớn cho đến nay .
· Xét nghiệm chức năng tiểu cầu để dự đoán chảy máu
Những biến cố chảy máu nặng cũng có cơ sở rất độc lạ và rất khó dự đoán2, 49. Ngoài những yếu tố rủi ro tiềm ẩn đã biết, phản ứng tiểu cầu thấp trong điều trị ( LPR ) đã được chăm sóc bởi 1 số ít nghiên cứu50, 51. Cụ thể, ngày càng tăng rủi ro tiềm ẩn chảy máu khi sử dụng những chất ức chế P2Y12 mạnh hơn có tương quan thân thiện hơn với mức độ giảm huyết khối trong stent hoặc nhồi máu cơ tim5, 6, 8 .
Tuy nhiên, giá trị và tính đúng mực của LPR để Dự kiến chảy máu ở những bệnh nhân được điều trị bằng thuốc ức chế P2Y12 vẫn còn tranh cãi với cả hai điều tra và nghiên cứu ủng hộ15, 50-54 và không ủng hộ được công bố cho đến nay23, 55 ( ▶ Bảng 2-3 ). Một hạn chế quan trọng là thiếu sự chuẩn hóa trong định nghĩa của những biến cố chảy máu, thời hạn theo dõi và giải quyết và xử lý những biến cố chảy máu trong hầu hết những điều tra và nghiên cứu. Đáng quan tâm là trong những nghiên cứu và điều tra lớn nhất cho đến nay, Dữ liệu Đăng ký sổ bộ ADAPT-DES, chứng tỏ rằng phản ứng tiểu cầu so với ADP Dự kiến độc lập những biến cố chảy máu nặng một năm sau PCI ( HR so với PRU < 208 : 1,37, KTC 95 % : 1,12 - 1,64, p = 0,002 ) 15 .
Ở những bệnh nhân được điều trị với prasugrel, có hai nghiên cứu và điều tra đã chỉ ra mối liên hệ có ý nghĩa giữa mức độ ức chế tiểu cầu và chảy máu52, 53. Trong điều tra và nghiên cứu của Bonello et al., 301 bệnh nhân HCMVC sau PCI được theo dõi trong một năm. Nguy cơ chảy máu cao hơn ở bệnh nhân dưới 16 % PRI ( 15,6 % so với 3,3 % ; p < 0,001 ) 53. Trong nghiên cứu và điều tra của Cuisset et al., 1.542 bệnh nhân HCMVC được theo dõi trong vòng sáu tháng sau PCI, và những người có phản ứng tiểu cầu trong điều trị rất thấp ( PRI < 10 % ) có rủi ro tiềm ẩn chảy máu cao hơn đáng kể, theo tiêu chuẩn Bleeding Academic Research Consortium ( BARC ) Class 2-4 ( OR : 4.7, KTC 95 % : 2,7 - 8,3 ; p < 0,001 ) 52. Đáng chú ý quan tâm là hầu hết những biến cố chảy máu thuộc loại nhẹ ( Class 2 ) và một tỷ suất lớn đã xảy ra trong thời hạn nhập viện ; Do đó, sự tương quan của điểm cắt này về thực trạng chảy máu tự nhiên nặng là không rõ ràng .
Không có điều tra và nghiên cứu nào được công bố về mối tương quan giữa phản ứng tiểu cầu và chảy máu ở những bệnh nhân được điều trị với ticagrelor cho đến nay. Tuy nhiên, những nghiên cứu và điều tra dược động học cho thấy ticagrelor tối thiểu cũng mạnh như prasugrel ở những bệnh nhân HCMVC56 .
Dựa trên những dẫn chứng đã tranh luận, điểm cắt sơ bộ được ý kiến đề nghị để Dự kiến xuất huyết ở bệnh nhân HCMVC trải qua PCI gồm có 95 PRU với VerifyNow ® ( 57 ), 19 U với Multiplate ® 50 và 10 % với xét nghiệm VASP ® 52. Điểm cắt được ý kiến đề nghị cho VASP ® khác với điểm cắt được tài liệu đồng thuận ở đầu cuối đề nghị9. Tuy nhiên, điểm cắt 10 % PRI đã được đánh giá và thẩm định trong một nghiên cứu và điều tra lớn chưa xuất bản tại thời gian tài liệu đồng thuận trước đó nói đến. Cần phải nhấn mạnh vấn đề rằng những điểm cắt hầu hết đã được chi phối bởi những nghiên cứu và điều tra về điều trị clopidogrel. Mối tương quan của những ngưỡng này trong thời đại prasugrel và ticagrelor cần được xác lập .
Bảng 3: Điểm cắt tốt nhất đã được thẩm định của phản ứng tiểu cầu để dự đoán huyết khối và chảy máu
|
Huyết khối trong stent |
Chảy máu |
|||||
|
Điểm cắt |
N |
Tham khảo |
Điểm cắt |
N |
Tham khảo |
|
| VerifyNow | > 208 PRU | 11.245 | ( 15,43 ) | < 95 PRU | 8.449 | ( 57 ) |
| Multiplate | > 46 U | 1.608 | ( 70 ) | < 19 U | 2.533 | ( 50 ) |
| VASO-P | > 50 % PRI | 640 | ( 47,53,71 ) | < 10 % PRI | 1.542 | ( 52 ) |
| PRU : đơn vị chức năng phản ứng tiểu cầu, U : đơn vị chức năng ngưng kết, PRI : chỉ số phản ứng tiểu cầu | ||||||
· Sửa đổi điều trị dựa trên xét nghiệm chức năng tiểu cầu: điều này có vai trò trong phòng ngừa chảy máu hoặc huyết khối trong stent hay không?
Mặc dù phản ứng tiểu cầu so với ADP hoàn toàn có thể là một chỉ dấu rủi ro tiềm ẩn có giá trị tiên lượng để Dự kiến rủi ro tiềm ẩn huyết khối trong stent và chảy máu ở những bệnh nhân HCMVC sau PCI, vẫn không chắc như đinh liệu nó hoàn toàn có thể được sử dụng để hướng dẫn nhằm mục đích cải tổ kết cục lâm sàng hay không, vì phản ứng tiểu cầu là một đặc thù có năng lực đổi khác như một yếu tố rủi ro tiềm ẩn. Chất ức chế P2Y12 mạnh làm giảm một cách hiệu suất cao phản ứng tiểu cầu39, 40, trong khi giảm liều thuốc hoặc quy đổi sang những thuốc ít hiệu lực thực thi hiện hành hơn thì phản ứng tiểu cầu gia tăng58. Phản ứng tiểu cầu với ADP không chỉ là một chỉ dấu của tính năng thuốc mà còn phản ánh sự tích hợp của nhiều bệnh lý kèm theo tương quan đến bệnh nhân làm ảnh hưởng tác động đến phản ứng tiểu cầu khởi đầu, ví dụ điển hình như tuổi tác, đái tháo đường và suy thận3 .
Nghiên cứu GRAVITAS59, thử nghiệm lâm sàng đối chứng, ngẫu nhiên tiên phong, nghiên cứu và điều tra sự biến hóa điều trị theo phản ứng tiểu cầu với 2.214 bệnh nhân có rủi ro tiềm ẩn thấp đến trung bình trải qua PCI. Chỉ có 10 % số bệnh nhân này có nhồi máu cơ tim cấp trong thời hạn tuyển chọn. Việc sử dụng một giá trị điểm cắt 230 PRU ( Verify Now ® ) để tách biệt những bệnh nhân theo HTPR, hiệu suất cao lâm sàng của clopidogrel 150 mg so với 75 mg được so sánh về tần suất tử trận, nhồi máu cơ tim hoặc huyết khối trong stent lúc 6 tháng. Vì thế, tiêu chuẩn chính giống nhau ở cả hai nhóm điều trị ngẫu nhiên ( 2,3 % so với 2,3 % ) 59
Thử nghiệm ngẫu nhiên đa TT ARCTIC60 nhằm mục đích so sánh những quyền lợi lâm sàng tiềm năng của chiêu thức điều trị dựa trên chức năng tiểu cầu và kế hoạch điều trị theo lâm sàng ở những bệnh nhân có rủi ro tiềm ẩn trung bình trải qua PCI gồm có 27 % bệnh nhân bị NMCT cấp. Trong điều tra và nghiên cứu này, không riêng gì sự ức chế phản ứng tiểu cầu so với ADP đã được sử dụng để xác lập HTPR với điểm cắt là 235 PRU ( Verify Now ® ), mà tỉ lệ phần trăm so với bắt đầu phản ứng tiểu cầu với axit arachidonic cũng đã được sử dụng60. Tiêu chí chính là tử trận do bất kể nguyên do nào, nhồi máu cơ tim, huyết khối trong stent, đột quỵ / cơn thiếu máu não thoáng qua hoặc tái thông mạch máu khẩn cấp trong vòng một năm thì không khác nhau giữa nhóm không và nhóm có theo dõi chức năng tiểu cầu ( 31,1 % so với 34,6 % ). Nhóm có theo dõi sử dụng giải pháp đa phần là tăng liều clopidogrel và truyền chất ức chế GPIIb / IIIa trong thủ pháp PCI60 .
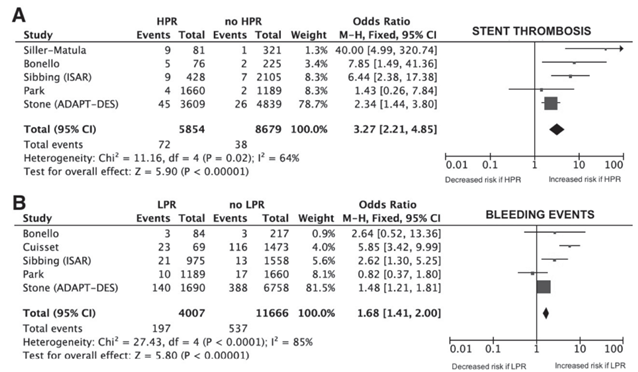
Hình 2: Nguy cơ tương đối (RR) đối với huyết khối trong stent (A) và chảy máu (B) ở những bệnh nhân có phản ứng tiểu cầu cao (HPR) hoặc thấp (LPR).Dữ liệu được vẽ sơ đồ từ những nghiên cứu sử dụng những xét nghiệm phản ứng tiểu cầu đã lưu hành thương mại (Verify Now®, Multiplate, và VASP) bao gồm hơn 300 bệnh nhân. Những nghiên cứu được xếp theo thứ tự theo tỉ số (weight) tăng dần trong kết quả chung.
Bảng 4: So sánh giữa những thử nghiệm ngẫu nhiên và dữ liệu phân tích sổ bộ nhằm đánh giá lợi ích lâm sàng của việc điều chỉnh điều trị dựa trên xét nghiệm phản ứng tiểu cầu
|
GRAVITAS (59) |
ARCTIC(60) |
RECLOSE-2 ACS (69) |
PECSREGISTRY (45) |
ISAR-HPR (64) |
MADONA (63) |
|
|
Đặc tính nguy cơ của bệnh nhân |
||||||
| Thiết kế điều tra và nghiên cứu | RCT | RCT | Sổ bộ tiền cứu | Sổ bộ tiền cứu | Nghiên cứu đối chứng hồi cứu | Đăng ký tiền cứu |
| Số lượng bệnh nhân | 2.214 | 2.440 | 1.789 | 741 | 999 | 798 |
| ACS ( % ) | 40 % | 27 % | 100 % | 100 % | 50 % | 37 % |
| AMI ( % ) | 10 % | – | – | 84 % | 33 % | 37 % |
| STEMI ( % ) | 0,4 % | 0 % | 46 % | 48 % | 15 % | 12 % |
| Sốc ( % ) | 0 % | 0 % | 6 % | 4,5 % | N / A | N / A |
| Tử vong ( % ) | 0,8 % | 2 % | 5 % | 8,2 % |
1,2 % ( 30 ngày ) |
1,6 % ( 30 ngày ) |
|
Can thiệp kháng tiểu cầu |
||||||
| Clopidogrel liều cao ( được hướng dẫn hoặc nhóm HPR ) ( % ) | 100 % | 80 % | 100 % | 58 % | 15 % | 100 % |
| ASA liều cao ( % ) | – | 45 % | – | – | – | – |
| Prasugrel | – | 12 | – | 42 | 20 | 14 |
| Xét nghiệm PFT | VerifyNow | VerifyNow | LTA | Multiplate | Multiplate | Multiplate |
|
Kết quả |
||||||
| So sánh | 150 mg so với 75 mg clopidogrel trong HPR | Theo dõi so với điều trị thường thì | HPR + liều cao clopidogrel so với không HPR | liều cao clopidogrel so với prasugrel trong HPR | Theo dõi so với điều trị thường thì | Theo dõi so với điều trị thường thì |
| Tiêu chí số 1 | Tử vong tim mạch, nhồi máu cơ tim hoặc huyết khối trong stent ở thời gian 6 tháng | Tử vong tim mạch, nhồi máu cơ tim, tái thông mạch máu khẩn cấp, đột quị ở thời gian 1 năm | Tử vong tim mạch, nhồi máu cơ tim, tái thông mạch máu khẩn cấp, đột quị ở thời gian 2 năm | Tử vong mọi nguyên do, nhồi máu cơ tim, huyết khối stent hoặc đột quị ở thời gian 1 năm | Tử vong hoặc huyết khối stent ở thời gian 30 ngày | huyết khối sten ở thời gian 30 ngày |
| Kết quả ( % ) | 2,3 so với 2,3 ( p = 0,97 ) | 31,1 so với 34,6 ( p = 0,10 ) | 14,6 so với 8,7 | 16,5 so với 7,1 * ( p < 0,0001 ) | 1,2 so với 3,7 ( p = 0,009 | 0,2 so với 1,9 ( p = 0,027 ) |
| * So sánh giữa clopidogrel liều cao và prasugrel ; ASA acetylic salicylic acid, PFT : xét nghiệm chức năng tiểu cầu, HPR : phản ứng tiểu cầu cao, AMI : nhồi máu cơ tim cấp, STEMI : nhồi máu cơ tim có ST chênh | ||||||
Các điều tra và nghiên cứu ngẫu nhiên hiện có không tương hỗ vai trò của phản ứng tiểu cầu trong việc cải tổ kết cục sau PCI cấp. Tuy nhiên, sự hiểu biết của tất cả chúng ta về phản ứng tiểu cầu đã biến hóa hầu hết kể từ phong cách thiết kế và khởi đầu những điều tra và nghiên cứu này :
i ) Phản ứng tiểu cầu với ADP là một chỉ dấu tiên lượng đáng đáng tin cậy hầu hết trong HCMVC, nhưng ít có giá trị trong bệnh đau thắt ngực ổn định37
ii ) Trong khi phản ứng tiểu cầu so với ADP hoàn toàn có thể là một chỉ dấu tiên lượng tốt, thì việc đo phân phối ASA và Phần Trăm ức chế P2Y12 lại không được khuyến cáo3
iii ) Liều cao của clopidogrel đem lại quyền lợi nhã nhặn và không hằng định ở những bệnh nhân HCMV cấp bị HPR và không nên được sử dụng45
iv ) Tỷ lệ tử trận, huyết khối trong stent xác lập / hoàn toàn có thể xảy ra cùng với chảy máu nặng là những tiêu chuẩn tương thích nhất để đánh giá sự bảo đảm an toàn và hiệu suất cao trong những thử nghiệm như vậy .
Theo những hiệu quả nghiên cứu và điều tra, việc quy đổi bệnh nhân bị HTPR sang sử dụng prasugrel cho thấy giảm đáng kể tỷ suất tử trận, nhồi máu cơ tim, huyết khối trong stent hoặc đột quỵ so với liều cao của clopidogrel, mà không làm tăng rủi ro tiềm ẩn chảy máu45. Ngoài dữ liệu sổ bộ này, có hai điều tra và nghiên cứu không ngẫu nhiên khác ( ISAR-HPR và MADONNA ) 63,64, sử dụng xét nghiệm Multiplate ® và cho thấy xét nghiệm chức năng tiểu cầu có quyền lợi trong việc giảm rủi ro tiềm ẩn huyết khối trong stent trong toàn bộ những bệnh nhân được PCI .
· Phác đồ đề nghị cho điều trị kháng tiểu cầu cá nhân hóa trong tương lai
Bệnh nhân hoàn toàn có thể có quyền lợi từ một phác đồ rủi ro tiềm ẩn tổng thể và toàn diện dựa trên thông tin lâm sàng ( điểm số PREDICT ), sinh học ( chức năng tiểu cầu ) và di truyền ( thực trạng mang gen CYP2C19 * 2 ) ( Hình 3 ). Trong khi xét nghiệm chức năng tiểu cầu phát hiện những bệnh nhân nào không cung ứng khá đầy đủ với clopidogrel, xét nghiệm dược di truyền chỉ đem lại một chỉ dấu về rủi ro tiềm ẩn so với HTPR. Kiểu gen đơn thuần hoàn toàn có thể giúp xu thế điều trị kháng tiểu cầu trong một số ít trường hợp lâm sàng đơn cử, ví dụ điển hình so với đặt stent chương trình những sang thương phức tạp hoặc của thân chung mạch vành trái trước khi uống clopidogrel, đặc biệt quan trọng khi bệnh nhân đó đồng hợp tử với gen tương ứng CYP2C19 * 2, vì những bệnh nhân này có năng lực cao tăng trưởng HTPR trong khi điều trị với clopidogrel. Tuy nhiên, hạn chế lớn của kiểu gen là sự không chắc như đinh trong Dự kiến kiểu hình của phân phối clopidogrel. Hơn nữa, phân phối với clopidogrel thì thậm chí còn còn ít được Dự kiến hơn trong những cá thể với kiểu tự nhiên hoặc dị hợp tử so với CYP2C19 * 2. Dựa trên những xem xét này, những người mang gen đồng hợp tử của CYP2C19 * 2 hoàn toàn có thể có quyền lợi từ điều trị với những thuốc kháng tiểu cầu mạnh hơn như prasugrel hoặc ticagrelor, trong khi ở những người nhóm tự nhiên hoặc người mang gen dị hợp tử của CYP2C19 * 2, xét nghiệm chức năng tiểu cầu hoàn toàn có thể đem lại một thông tin bổ trợ .
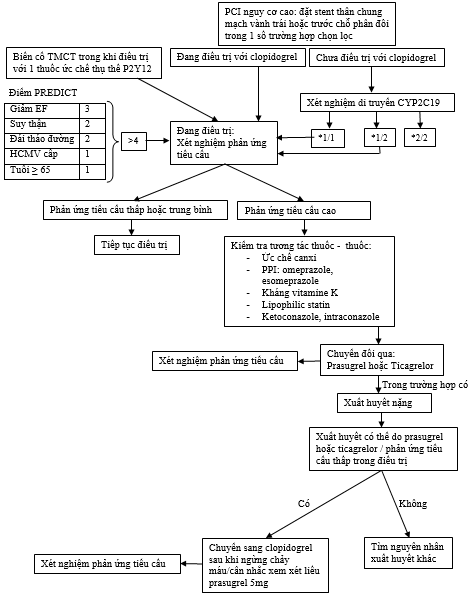
Hình 3: Phác đồ đề nghị đối với điều trị kháng tiểu cầu cá nhân hóa với các thuốc chẹn thụ thể P2Y12. * Điểm PREDICT có thể được sử dụng khi ticagrelor hoặc prasugrel không có sẳn hoặc chống chỉ định.
Tóm lại:
1. Các xét nghiệm chức năng tiểu cầu hiện có thống kê giám sát những góc nhìn khác nhau của sự kích hoạt-ngưng kết tiểu cầu dẫn đến mối đối sánh tương quan chỉ từ thấp đến trung bình giữa chúng và sự không tương đương hoàn toàn có thể có trong phân loại bệnh nhân. Do đó, những xét nghiệm tiểu cầu không hề thay thế sửa chữa cho nhau .
2. Các xét nghiệm được khuyến nghị để đo lường và thống kê phản ứng tiểu cầu trong thực trạng ức chế P2Y12 gồm có : VASP-P ®, VerifyNow ® và máy nghiên cứu và phân tích Multiplate ®. LTA không được khuyến nghị cho việc sử dụng thường qui do thiếu sự chuẩn hóa .
3. Khi đánh giá giá trị của những xét nghiệm chức năng tiểu cầu trong việc Dự kiến nguy cơ biến chứng huyết khối hoặc chảy máu, độ mạnh của mối quan hệ giữa Dự kiến và kết cục phải được báo cáo giải trình ( vd : OR hoặc HR ). Giá trị tiên đoán không được khuyến nghị vì chúng chịu tác động ảnh hưởng đa phần bởi tần suất lưu hành của những kết cục, điều này hoàn toàn có thể gây hiểu nhầm tương quan đến ứng dụng lâm sàng .
4. Xét nghiệm chức năng tiểu cầu hoàn toàn có thể được xem xét để theo dõi sự tuân thủ của bệnh nhân và chẩn đoán việc ngừng sớm chất ức chế P2Y12 khi việc ngưng thuốc không rõ ràng trên lâm sàng .
5. HTPR trong khi điều trị với clopidogrel, Dự kiến độc lập sự Open của huyết khối trong stent ở bệnh nhân HCMVC trải qua PCI cấp tính. Tuy nhiên, lâm sàng và thủ pháp cũng có ảnh hưởng tác động lớn. Do đó, phản ứng tiểu cầu nên được đánh giá trong toàn cảnh lâm sàng của bệnh nhân .
6. Giá trị tiên lượng của HTPR không rõ ràng ở những bệnh nhân HCMVC được điều trị bảo tồn hoặc ở những bệnh nhân được điều trị với prasugrel hoặc ticagrelor .
7. Mặc dù những điểm cắt để Dự kiến rủi ro tiềm ẩn cao hơn của huyết khối trong stent hoàn toàn có thể nhờ vào vào biểu lộ lâm sàng và hiện vẫn đang được đánh giá và thẩm định, những ngưỡng đề xuất so với những xét nghiệm hiện đã lưu hành trên thị trường là 208 PRU trong trường hợp VerifyNow ®, 46 U trong trường hợp Multiplate ® và 50 % trong trường hợp VASP-P ® .
8. LPR có tương quan đến biến chứng chảy máu. Điểm cắt sơ bộ so với rủi ro tiềm ẩn chảy máu cao là 95 PRU với VerifyNow ®, 19 U với Multiplate ® và 10 % với xét nghiệm VASP-P ®, nhưng cần có những điều tra và nghiên cứu sâu hơn để xác định những ngưỡng này .
9. Không có dẫn chứng rằng sửa đổi điều trị dựa trên xét nghiệm chức năng tiểu cầu hoàn toàn có thể cải tổ kết cục ở những bệnh nhân trải qua PCI .
10. Mặc dù thiết yếu có điều tra và nghiên cứu lâm sàng sâu hơn để đánh giá vai trò của xét nghiệm chức năng tiểu cầu trong việc phòng ngừa huyết khối trong trong stent và chảy máu, việc đánh giá chức năng tiểu cầu trong lâm sàng thường qui lúc bấy giờ không được khuyến nghị. Trừ khi có chống chỉ định, bệnh nhân HCMVC nên được điều trị với prasugrel hoặc ticagrelor .
11. Việc sửa đổi điều trị dựa trên xét nghiệm chức năng tiểu cầu có thể hợp lý ở một số bệnh nhân nhất định bị biến chứng huyết khối hoặc xuất huyết trong khi đang tuân thủ điều trị với các thuốc ức chế P2Y12.
Tài liệu tham khảo
1. Steg PG, James SK, Atar D, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. EurHeart J 2012; 33: 2569–2619.
2. Hamm CW, Bassand JP, Agewall S, et al. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2011; 32: 2999–3054.
3. Aradi D, Storey RF, Komocsi A, et al. Expert position paper on the role of platelet function testing in patients undergoing percutaneous coronary intervention. Eur Heart J 2014; 35: 209–215.
4. Aradi D, Komócsi A, Vorobcsuk A, et al. Impact of clopidogrel and potent P2Y12 -inhibitors on mortality and stroke in patients with acute coronary syndrome or undergoing percutaneous coronary intervention: a systematic review and meta-analysis. Thrombosis and haemostasis 2013; 109: 93–101.
5. Wiviott SD, Braunwald E, McCabe CH, et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357: 2001–2015.
6. Wallentin L, Becker RC, Budaj A, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361: 1045–1057.
7. Mehta S, Yusuf S, Peters R, et al. Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronaryintervention: the PCI-CURE study. Lancet 2001; 358: 527–533.
8. Steg PG, Bhatt DL, Hamm CW, et al. Effect of cangrelor on periprocedural outcomes in percutaneous coronary interventions: a pooled analysis of patientlevel data. Lancet 2013; 382: 1981–1992.
9. Tantry US, Bonello L, Aradi D, et al. Consensus and update on the definition of on-treatment platelet reactivity to adenosine diphosphate associated with ischaemia and bleeding. J Am Coll Cardiol 2013; 62: 2261–2273.
10. Montalescot G, Sechtem U, Achenbach S, et al. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013; 34: 2949–3003.
11. Davi G, Patrono C. Platelet activation and atherothrombosis. N Engl J Med 2007; 357: 2482–2494.
12. Gurbel PA, Bliden KP, DiChiara J, et al. Evaluation of dose-related effects of aspirin on platelet function: results from the Aspirin-Induced Platelet Effect (ASPECT) study. Circulation 2007; 115: 3156–3164.
13. Kovacs EG, Katona E, Bereczky Z, et al. New direct and indirect methods for the detection of cyclooxygenase 1 acetylation by aspirin; the lack of aspirin resistance among healthy individuals. Thromb Res 2013; 131: 320–324.
14. Kovacs EG, Katona E, Bereczky Z, et al. Evaluation of laboratory methods routinely used to detect the effect of aspirin against new reference methods. Thromb Res 2014; 133: 811–816.
15. Stone GW, Witzenbichler B, Weisz G, et al. Platelet reactivity and clinical outcomes after coronary artery implantation of drug-eluting stents (ADAPT-DES):a prospective multicentre registry study. Lancet 2013; 382: 614–623.
16. Mehta SR, Bassand JP, Chrolavicius S, et al. Dose comparisons of clopidogrel and aspirin in acute coronary syndromes. N Engl J Med 2010; 363: 930–942.
17. Sumaya W, Daly RL, Mehra S, et al. Hirudin anticoagulation allows more rapid determination of P2Y(1)(2) inhibition by the VerifyNow P2Y12 assay. Thromb Haemost 2013; 109: 550–555.
18. Sumaya W, Joshi RR, Judge HM, et al. Stability of VerifyNow P2Y12 assay results with citrate anticoagulation as compared to hirudin anticoagulation over 20-min period. Platelets 2014; Epub ahead of print.
19. Hubner U, Bockel-Frohnhofer N, Hummel B, et al. The effect of a pneumatic tube transport system on platelet aggregation using optical aggregometry and the PFA-100. Clin Lab 2010; 56: 59–64.
20. Johnston LR, Larsen PD, La Flamme AC, et al. Methodological considerations for the assessment of ADP induced platelet aggregation using the Multiplate(R) analyser. Platelets 2013; 24: 303–307.
21. Jeong YH, Bliden KP, Tantry US, et al. High on-treatment platelet reactivity assessed by various platelet function tests: is the consensus-defined cut-off of VASP-P platelet reactivity index too low? J Thromb Haemost 2012; 10: 487–489.
22. Lordkipanidzé M, Pharand C, Nguyen T, et al. Comparison of four tests to assess inhibition of platelet function by clopidogrel in stable coronary artery disease patients. Eur Heart J 2008; 29: 2877–2885.
23. Breet NJ, van Werkum JW, Bouman HJ, et al. Comparison of platelet function tests in predicting clinical outcome in patients undergoing coronary stent implantation. J Am Med Assoc 2010; 303: 754–762.
24. Siller-Matula JM, Delle-Karth G, Lang IM, et al. Phenotyping vs genotyping for prediction of clopidogrel efficacy and safety: the PEGASUS-PCI study. J Thromb Haemost 2012; 10: 529–542.
25. Freynhofer MK, Brozovic I, Bruno V, et al. Multiple electrode aggregometry and vasodilator stimulated phosphoprotein-phosphorylation assay in clinical routine for prediction of postprocedural major adverse cardiovascular events. Thromb Haemost 2011; 106: 230–239.
26. Cuisset T, Frere C, Quilici J, et al. Predictive values of post-treatment adenosine diphosphate-induced aggregation and vasodilator-stimulated phosphoprotein index for stent thrombosis after acute coronary syndrome in clopidogrel-treated patients. Am J Cardiol 2009; 104: 1078–1082.
27. Keller T, Zeller T, Peetz D, et al. Sensitive troponin I assay in early diagnosis of acute myocardial infarction. N Engl J Med 2009; 361: 868–877.
28. Hijazi Z, Oldgren J, Siegbahn A, et al. Biomarkers in atrial fibrillation: a clinical review. Eur Heart J 2013; 34: 1475–1480.
29. Dahlen JR, Price MJ, Parise H, et al. Evaluating the clinical usefulness of platelet function testing: Considerations for the proper application and interpretation of performance measures. Thromb Haemost 2013; 109: 808–816.
30. Airoldi F, Colombo A, Morici N, et al. Incidence and predictors of drug-eluting stent thrombosis during and after discontinuation of thienopyridine treatment. Circulation 2007; 116: 745–754.
31. Brodie B, Pokharel Y, Garg A, et al. Predictors of early, late, and very late stent thrombosis after primary percutaneous coronary intervention with bare-metal and drug-eluting stents for ST-segment elevation myocardial infarction. JACC Cardiovasc Interv 2012; 5: 1043–1051.
32. Cayla G, Hulot JS, OConnor SA, et al. Clinical, angiographic, and genetic factors associated with early coronary stent thrombosis.. J Am Med Assoc 2011; 306: 1765–1774.
33. Aradi D, Komocsi A, Vorobcsuk A, et al. Prognostic significance of high onclopidogrel platelet reactivity after percutaneous coronary intervention: systematic review and meta-analysis. Am Heart J 2010; 160: 543–551.
34. Brar SS, ten Berg J, Marcucci R, et al. Impact of platelet reactivity on clinical outcomes after percutaneous coronary intervention. A collaborative meta-analysis of individual participant data. J Am Coll Cardiol 2011; 58: 1945–1954.
35. Combescure C, Fontana P, Mallouk N, et al. Clinical implications of clopidogrel non-response in cardiovascular patients: a systematic review and meta-analysis. J Thromb Haemost 2010; 8: 923–933.
36. Sofi F, Marcucci R, Gori AM, et al. Clopidogrel non-responsiveness and risk of cardiovascular morbidity. An updated meta-analysis. Thromb Haemost 2010; 103: 841–848.
37. Kirtane AJ, Rinaldi M, Parise H, et al. Impact of Point-of-Care Platelet Function Testing among Patients with and without Acute Coronary Syndromes Undergoing Pci with Drug-Eluting Stents: An Adapt-Des Substudy. J Am Coll Cardiol2012; 59: E291.
38. Gurbel P, Erlinge D, Ohman E, et al. Platelet function during extended prasugrel and clopidogrel therapy for patients with ACS treated without revascularisation:the TRILOGY ACS platelet function substudy.. J Am Med Assoc 2012; 308:1785–1794.
39. Gurbel P, Bliden K, Butler K, et al. Response to ticagrelor in clopidogrel nonresponders and responders and effect of switching therapies: the RESPOND study. Circulation 2010; 121: 1188–1199.
40. Wiviott S, Trenk D, Frelinger A, et al. Prasugrel compared with high loadingand maintenance-dose clopidogrel in patients with planned percutaneous coronary intervention: the Prasugrel in Comparison to Clopidogrel for Inhibition of Platelet Activation and Aggregation-Thrombolysis in Myocardial Infarction 44 trial. Circulation 2007; 116: 2923–2932.
41. Bonello L, Pansieri M, Mancini J, et al. High on-treatment platelet reactivity after prasugrel loading dose and cardiovascular events after percutaneous coronary intervention in acute coronary syndromes. J Am Coll Cardiol 2011; 58:467–473.
42. Price MJ, Endemann S, Gollapudi RR, et al. Prognostic significance of postclopidogrel platelet reactivity assessed by a point-of-care assay on thrombotic events after drug-eluting stent implantation. Eur Heart J 2008; 29: 992–1000.
43. Price M, Angiolillo D, Teirstein P, et al. Platelet reactivity and cardiovascular outcomes after percutaneous coronary intervention: a time-dependent analysis of the Gauging Responsiveness with a VerifyNow P2Y12 assay: Impact on Thrombosis and Safety (GRAVITAS) trial. Circulation 2011; 124: 1132–1137.
44. Schulz S, Sibbing D, Braun S, et al. Platelet response to clopidogrel and restenosis in patients treated predominantly with drug-eluting stents. Am Heart J 2010;160: 355–361.
45. Aradi D, Tornyos A, Pinter T, et al. Optimizing P2Y-receptor inhibition in acute coronary syndrome patients based on platelet function testing: impact of prasugrel and high-dose clopidogrel. J Am Coll Cardiol 2014; Epub ahead of print.
46. Blindt R, Stellbrink K, de Taeye A, et al. The significance of vasodilator-stimulated phosphoprotein for risk stratification of stent thrombosis. Thromb Haemost 2007; 98: 1329–1334.
47. Bonello L, Paganelli F, Arpin-Bornet M, et al. Vasodilator-stimulated phosphoprotein phosphorylation analysis prior to percutaneous coronary intervention for exclusion of postprocedural major adverse cardiovascular events. J Thromb Haemost 2007; 5: 1630–1636.
48. El Ghannudi S, Ohlmann P, Meyer N, et al. Impact of P2Y12 inhibition by clopidogrel on cardiovascular mortality in unselected patients treated by percutaneous coronary angioplasty: a prospective registry. JACC Cardiovasc Interv 2010; 3: 648–656.
49. Steg PG, Huber K, Andreotti F, et al. Bleeding in acute coronary syndromes and percutaneous coronary interventions: position paper by the Working Group on Thrombosis of the European Society of Cardiology. Eur Heart J 2011; 32: 1854–1864.
50. Sibbing D, Schulz S, Braun S, et al. Antiplatelet effects of clopidogrel and bleeding in patients undergoing coronary stent placement. J Thromb Haemost 2010;8: 250–256.
51. Campo G, Parrinello G, Ferraresi P, et al. Prospective evaluation of on-clopidogrel platelet reactivity over time in patients treated with percutaneous coronary intervention relationship with gene polymorphisms and clinical outcome. J AmColl Cardiol 2011; 57: 2474–2483.
52. Cuisset T, Grosdidier C, Loundou AD, et al. Clinical Implications of Very Low On-Treatment Platelet Reactivity in Patients Treated With Thienopyridine.JACC: Cardiovasc Interv 2013; 6: 854–863.
53. Bonello L, Mancini J, Pansieri M, et al. Relationship between post-treatment platelet reactivity and ischaemic and bleeding events at 1-year follow-up in patients receiving prasugrel. J Thromb Haemost 2012; 10: 1999–2005.
54. Mangiacapra F, Patti G, Barbato E, et al. A therapeutic window for platelet reactivity for patients undergoing elective percutaneous coronary intervention: results of the ARMYDA-PROVE (Antiplatelet therapy for Reduction of Myocardial Damage during Angioplasty-Platelet Reactivity for Outcome Validation Effort) study. JACC Cardiovasc Interv 2012; 5: 281–289.
55. Park DW, Lee SW, Yun SC, et al. A point-of-care platelet function assay and C-reactive protein for prediction of major cardiovascular events after drug-eluting stent implantation. J Am Coll Cardiol 2011; 58: 2630–2639.
56. Alexopoulos D, Xanthopoulou I, Gkizas V, et al. Randomized assessment of ticagrelor versus prasugrel antiplatelet effects in patients with ST-segment-elevation myocardial infarction. JACC Cardiovasc Interv 2012; 5: 797–804.
57. Kirtane AJ; Stuckey T; Xu K et al. Is There a Therapeutic Window For Platelet Responsiveness Among PCI Patients? Analysis from the ADAPT-DES Study. JAm Coll Cardiol 2013; 62: B48–49.
58. Kerneis M, Silvain J, Abtan J, et al. Switching acute coronary syndrome patients from prasugrel to clopidogrel. JACC Cardiovasc Interv 2013; 6: 158–165.
59. Price MJ, Berger PB, Teirstein PS, et al. Standard- vs high-dose clopidogrel based on platelet function testing after percutaneous coronary intervention: the GRAVITAS randomized trial. J Am Med Assoc 2011; 305: 1097–1105.
60. Collet JP, Cuisset T, Range G, et al. Bedside monitoring to adjust antiplatelet therapy for coronary stenting. N Engl J Med 2012; 367: 2100–2109.
61. Aradi D, Komocsi A, Price MJ, et al. Efficacy and safety of intensified antiplatelet therapy on the basis of platelet reactivity testing in patients after percutaneous coronary intervention: systematic review and meta-analysis. Int J Cardiol 2013; 167: 2140–2148.
62. Trenk D, Stone GW, Gawaz M, et al. A randomized trial of prasugrel versus clopidogrel in patients with high platelet reactivity on clopidogrel after elective percutaneous coronary intervention with implantation of drug-eluting stents: results of the TRIGGER-PCI (Testing Platelet Reactivity In Patients Undergoing Elective Stent Placement on Clopidogrel to Guide Alternative Therapy With Prasugrel) study. J Am Coll Cardiol 2012; 59: 2159–2164.
63. Siller-Matula JM, Francesconi M, Dechant C, et al. Personalized antiplatelet treatment after percutaneous coronary intervention: the MADONNA study. Int J Cardiol 2013; 167: 2018–2023.
64. Mayer K, Schulz S, Bernlochner I, et al. A comparative cohort study on personalised antiplatelet therapy in PCI-treated patients with high on-clopidogrel platelet reactivity. Results of the ISAR-HPR registry. Thromb Haemost 2014; 112: 342–351.
65. Mahla E, Suarez TA, Bliden KP, et al. Platelet function measurement-based strategy to reduce bleeding and waiting time in clopidogrel-treated patients undergoing coronary artery bypass graft surgery: the timing based on platelet function strategy to reduce clopidogrel-associated bleeding related to CABG (TARGET-CABG) study. JACC Cardiovasc Interv 2012; 5: 261–269.
66. Ferraris VA, Saha SP, Oestreich JH, et al. 2012 update to the Society of Thoracic Surgeons guideline on use of antiplatelet drugs in patients having cardiac and noncardiac operations. Ann Thoracic Surg 2012; 94: 1761–1781.
67. Sousa-Uva M, Storey R, Huber K, et al. Expert position paper on the management of antiplatelet therapy in patients undergoing coronary artery bypass graft surgery. Eur Heart J 2014; 35: 1510–1514.
68. Straub N, Beivers A, Lenk E, et al. A model-based analysis of the clinical and economic impact of personalising P2Y12-receptor inhibition with platelet function testing in acute coronary syndrome patients. Thromb Haemost 2014; 111:290–299.
69. Parodi G, Marcucci R, Valenti R, et al. High residual platelet reactivity after clopidogrel loading and long-term cardiovascular events among patients with acute coronary syndromes undergoing PCI. J Am Med Assoc 2011; 306: 1215–1223.
70. Sibbing D, Braun S, Morath T, et al. Platelet reactivity after clopidogrel treatment assessed with point-of-care analysis and early drug-eluting stent thrombosis. J Am Coll Cardiol 2009; 53: 849–856.
71. Frere C, Cuisset T, Quilici J, et al. ADP-induced platelet aggregation and platelet reactivity index VASP are good predictive markers for clinical outcomes in non- ST elevation acute coronary syndrome. Thromb Haemost 2007; 98: 838–843.
72. Tantry US, et al. Consensus and update on the definition of on-treatment platelet reactivity to adenosine diphosphate associated with ischaemia and bleeding. J Am Coll Cardiol 2013; 62: 2261–2273.
73. Siller-Matula JM, et al. Response Variability to P2Y12 Receptor Inhibitors: Expectations and Reality. JACC Cardiovasc Interv 2013; 6: 1111–1128.
74. Sibbing D, et al. Platelet Reactivity After Clopidogrel Treatment Assessed With Point-of-Care Analysis and Early Drug-Eluting Stent Thrombosis. J Am Coll Cardiol 2009; 53: 849–856.
75. Siller-Matula JM, et al. Multiple Electrode Aggregometry predicts stent thrombosis better than the VASP assay. J Thromb Haemost 2010; 8: 351–359.
76. Cuisset T, et al. Predictive values of post-treatment adenosine diphosphate-induced aggregation and vasodilator-stimulated phosphoprotein index for stent thrombosis after acute coronary syndrome in clopidogrel-treated patients. Am J Cardiol 2009; 104: 1078–1082.
77. Gurbel PA, et al. Clopidogrel effect on platelet reactivity in patients with stent thrombosis: results of the CREST Study. J Am Coll Cardiol 2005; 46: 1827–1832.
78. Geisler T, et al. Genetic variation of platelet function and pharmacology: An update of current knowledge. Thromb Haemost 2013; 110: 876–887.
79. Gurbel PA, et al. Platelet reactivity to adenosine diphosphate and long-term ischaemic event occurrence following percutaneous coronary intervention: a potential antiplatelet therapeutic target. Platelets 2008; 19: 595–604.
80. Hochholzer W, et al. Impact of the degree of peri-interventional platelet inhibition after loading with clopidogrel on early clinical outcome of elective coronary stent placement. J Am Coll Cardiol 2006; 48: 1742–1750.
81. Sibbing D, et al. Antiplatelet effects of clopidogrel and bleeding in patients undergoing coronary stent placement. J Thromb Haemost 2010; 8: 250–256.
82. Cuisset T, et al. Clinical implications of very low on-treatment platelet reactivity in patients treated with thienopyridine: the POBA study (predictor of bleedings with antiplatelet drugs). JACC Cardiovasc Interv 2013; 6: 854–863.
83. Angiolillo DJ. Antiplatelet therapy in diabetes: efficacy and limitations of current treatment strategies and future directions. Diabetes Care 2009; 32:531–540.
84. Muller K, et al. Impact of inflammatory markers on platelet inhibition and cardiovascular outcome including stent thrombosis in patients with symptomatic coronary artery disease. Atherosclerosis 2010; 213: 256–262.
85. Cattaneo M. Resistance to antiplatelet drugs: molecular mechanisms and laboratory detection. J Thromb Haemost 2007; 5 (Suppl 1): 230–237.
86. Sumaya W, et al. Hirudin anticoagulation allows more rapid determination of P2Y(1)(2) inhibition by the VerifyNow P2Y12 assay. Thromb Haemost 2013;109: 550–555.
87. Geisler T, et al. Early but not late stent thrombosis is influenced by residual platelet aggregation in patients undergoing coronary interventions. Eur Heart J 2010; 31: 59–66.
88. Geisler T, et al. Low response to clopidogrel is associated with cardiovascular outcome after coronary stent implantation. Eur Heart J 2006; 27: 2420–2425.
89. Michelson AD, et al. Pharmacodynamic assessment of platelet inhibition by prasugrel vs. clopidogrel in the TRITON-TIMI 38 trial. Eur Heart J 2009; 30:1753–1763.
90. Neubauer H, et al. Tailored antiplatelet therapy can overcome clopidogrel and aspirin resistance–the BOchum CLopidogrel and Aspirin Plan (BOCLA-Plan)to improve antiplatelet therapy. BMC Med 2011; 9: 3.
91. Breet NJ, et al. Comparison of platelet function tests in predicting clinical outcome in patients undergoing coronary stent implantation. J Am Med Assoc2010; 303: 754–762.
92. Neubauer H, et al. How to optimise clopidogrel therapy? Reducing the low-response incidence by aggregometry-guided therapy modification. Thromb Haemost 2008; 99: 357–362.
93. Gurbel PA, et al. Clopidogrel for coronary stenting: response variability, drug resistance, and the effect of pretreatment platelet reactivity. Circulation 2003;107: 2908–2913.
94. Li YG, et al. Inhibition of platelet aggregation with prasugrel and clopidogrel:an integrated analysis in 846 subjects. Platelets 2009; 20: 316–327.
95. Komosa A, et al. Comparison of the antiplatelet effect of two clopidogrel bisulfate formulations: Plavix and generic-Egitromb. Platelets 2014; Epub ahead of print.
96. Aradi D, et al. Optimizing P2Y12 receptor inhibition in patients with acute coronary syndrome on the basis of platelet function testing: impact of prasugrel and high-dose clopidogrel. J Am Coll Cardiol 2014; 63: 1061–1070.
97. Kozinski M, et al. Diurnal variation in platelet inhibition by clopidogrel. Platelets 2011; 22: 579–587.
98. Bonello L, et al. Tailored clopidogrel loading dose according to platelet reactivity monitoring to prevent acute and subacute stent thrombosis. Am J Cardiol 2009;103: 5–10.
99. Bonello L, et al. Adjusted clopidogrel loading doses according to vasodilatorstimulated phosphoprotein phosphorylation index decrease rate of major adverse cardiovascular events in patients with clopidogrel resistance: a multicenter randomized prospective study. J Am Coll Cardiol 2008; 51: 1404–1411.
100. Aleil B, et al. Clopidogrel 150 mg/day to overcome low responsiveness in patients undergoing elective percutaneous coronary intervention: results from the VASP-02 (Vasodilator-Stimulated Phosphoprotein-02) randomized study. JACC Cardiovasc Interv 2008; 1: 631–638.
101. Blindt R, et al. The significance of vasodilator-stimulated phosphoprotein for risk stratification of stent thrombosis. Thromb Haemost 2007; 98: 1329–1334.
102. Sibbing D, et al. Clopidogrel response status assessed with Multiplate point-ofcare analysis and the incidence and timing of stent thrombosis over six months following coronary stenting. Thromb Haemost 2010; 103: 151–159.
103. Lev EI, et al. Aspirin and clopidogrel drug response in patients undergoing percutaneous coronary intervention: the role of dual drug resistance. J Am Coll Cardiol 2006; 47: 27–33.
104. Frelinger AL, 3rd, et al. Intrinsic platelet reactivity before P2Y12 blockade contributes to residual platelet reactivity despite high-level P2Y12 blockade by prasugrel or high-dose clopidogrel. Results from PRINCIPLE-TIMI 44. ThrombHaemost 2011; 106: 219–226.
105. Campo G, et al. Prospective evaluation of on-clopidogrel platelet reactivity over time in patients treated with percutaneous coronary intervention relationship with gene polymorphisms and clinical outcome. J Am Coll Cardiol 2011; 57:2474–2483.
106. Elsenberg EH, et al. The influence of clinical characteristics, laboratory and inflammatory markers on high on-treatment platelet reactivity as measured with different platelet function tests. Thromb Haemost 2009; 102: 719–727.
107. Cuisset T, et al. Relation of low response to clopidogrel assessed with point-ofcare assay to periprocedural myonecrosis in patients undergoing elective coronary stenting for stable angina pectoris. Am J Cardiol 2008; 101: 1700–1703.
108. Price MJ, et al. Prognostic significance of post-clopidogrel platelet reactivity assessed by a point-of-care assay on thrombotic events after drug-eluting stent implantation. Eur Heart J 2008; 29: 992–1000.
109. Mayr FB, et al. The aptamer ARC1779 blocks von Willebrand factor-dependent platelet function in patients with thrombotic thrombocytopenic purpura ex vivo. Transfusion 2010; 50: 1079–1087.
110. Siller-Matula JM, et al. Cross validation of the Multiple Electrode Aggregometry.A prospective trial in healthy volunteers. Thromb Haemost 2009; 102:397–403.
111. Panzer S, et al. Monitoring survival and function of transfused platelets in Bernard-Soulier syndrome by flow cytometry and a cone and plate(let) analyzer(Impact-R). Transfusion 2007; 47: 103–106.
112. Spiel AO, et al. Single dose granulocyte colony-stimulating factor markedly enhances shear-dependent platelet function in humans. Platelets 2010; 21:464–469.
113. Frelinger AL, 3rd, et al. Association of cyclooxygenase-1-dependent and –independent platelet function assays with adverse clinical outcomes in aspirintreated patients presenting for cardiac catheterisation. Circulation 2009; 120:2586–2596.
114. Gurbel PA, et al. Platelet reactivity in patients and recurrent events post-stenting:results of the PREPARE POST-STENTING Study. J Am Coll Cardiol 2005;46: 1820–1826.
115. Mahla E, et al. Platelet function measurement-based strategy to reduce bleeding and waiting time in clopidogrel-treated patients undergoing coronary artery bypass graft surgery: the timing based on platelet function strategy to reduce clopidogrel-associated bleeding related to CABG (TARGET-CABG) study. Circ Cardiovasc Interv 2012; 5: 261–269.
117. Siller-Matula JM, et al. Phenotyping vs. genotyping for prediction of clopidogrel efficacy and safety: the PEGASUS-PCI study. J Thromb Haemost 2012; 10:529–542.
Source: https://tronbokienthuc.com
Category: Đánh Giá
